安評(píng)所開展醫(yī)療器械生物學(xué)評(píng)價(jià)試驗(yàn),產(chǎn)品通過技術(shù)審評(píng)
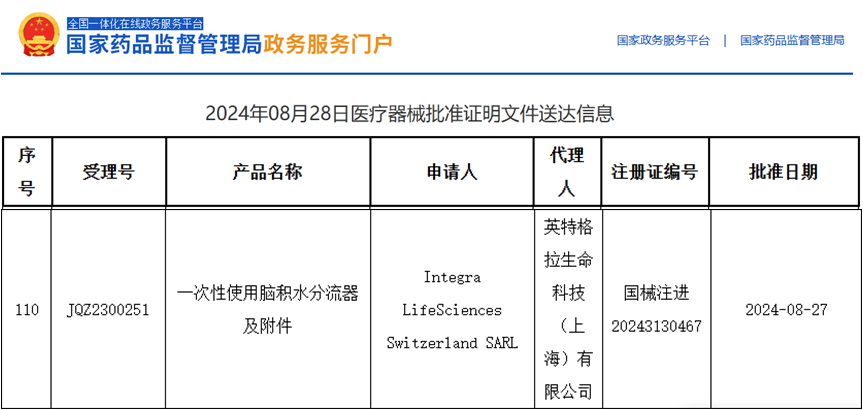
英特格拉生命科學(xué)(Integra?LifeSciences)集團(tuán)是全球領(lǐng)先的醫(yī)療科技公司,該公司所生產(chǎn)的神經(jīng)外科產(chǎn)品、手術(shù)器械和傷口護(hù)理產(chǎn)品遍及全球各地的醫(yī)院重癥監(jiān)護(hù)室及手術(shù)室。英特格拉生命科技(上海)有限公司為將神經(jīng)外科的主流產(chǎn)品(一次性使用腦積水分流器及其附件)在國(guó)內(nèi)進(jìn)行注冊(cè)申報(bào),委托安評(píng)所進(jìn)行該產(chǎn)品的皮下植入亞慢性全身毒性和局部反應(yīng)試驗(yàn)。
此類醫(yī)療器械皮下植入試驗(yàn)還未在本機(jī)構(gòu)開展過,為了該產(chǎn)品能夠提前順利進(jìn)入臨床試驗(yàn)階段,早日為人民群眾健康服務(wù),安評(píng)所領(lǐng)導(dǎo)將這一任務(wù)交給評(píng)價(jià)一部執(zhí)行,并明確指示要排除萬(wàn)難,盡早完成委托任務(wù),提交符合申報(bào)要求的醫(yī)療器械實(shí)驗(yàn)報(bào)告。部門承接任務(wù)的第一時(shí)間就召開了專題討論會(huì)并任命了有相關(guān)動(dòng)物手術(shù)實(shí)驗(yàn)經(jīng)歷的馮敏為專題負(fù)責(zé)人。該項(xiàng)目依據(jù)GB/T 16886醫(yī)療器械生物學(xué)評(píng)價(jià)、《藥物重復(fù)給藥毒性研究技術(shù)指導(dǎo)原則》、《醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則》、《一次性使用腦積水分流器注冊(cè)審查指導(dǎo)原則》,并參考相關(guān)技術(shù)資料,順利完成了一次性使用腦積水分流器及附件的家兔皮下植入13周亞慢性全身毒性和局部反應(yīng)試驗(yàn)。
該項(xiàng)目涉及手術(shù)操作,動(dòng)物麻醉,術(shù)后護(hù)理,樣品處理,病理組織,數(shù)據(jù)分析等各項(xiàng)技術(shù)要求,評(píng)價(jià)一部的參與人員克服種種困難,加班加點(diǎn),提前1個(gè)月完成了任務(wù)。英特格拉生命科技(上海)有限公司在結(jié)合各項(xiàng)申報(bào)資料后,通過了國(guó)家藥品監(jiān)督管理局的醫(yī)療器械技術(shù)審評(píng),該公司對(duì)安評(píng)所能在這么短時(shí)間內(nèi)完成任務(wù)表示非常感謝,并對(duì)其公司的其它產(chǎn)品試驗(yàn)提出了合作意向。通過該項(xiàng)目的執(zhí)行,體現(xiàn)了安評(píng)所踐行“一切為健康服務(wù)、為健康服務(wù)一切”的疾控精神,同時(shí)開展了新項(xiàng)目,積累了經(jīng)驗(yàn),鍛煉了隊(duì)伍,提高了本所對(duì)醫(yī)療器械動(dòng)物試驗(yàn)的評(píng)價(jià)水平。





 鄂公網(wǎng)安備42011102004892號(hào)
鄂公網(wǎng)安備42011102004892號(hào)


